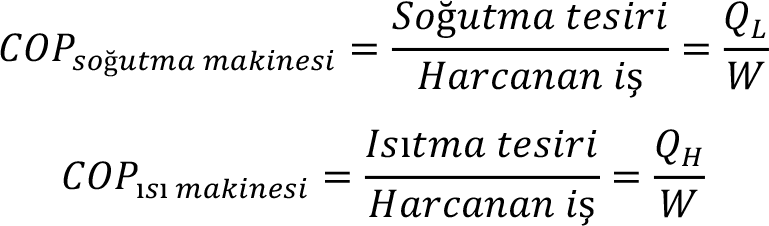ENERJİ ANALİZİ - Ünite 3: Termodinamik Temel Kavramlar Özeti :
PAYLAŞ:Ünite 3: Termodinamik Temel Kavramlar
Giriş
Termodinamik bilim dalı, enerji, enerji dönüşümleri ve özellikle ısı ve iş arasındaki etkileşimi inceler. Aslında madde ve enerjiyi ilgilendiren her şey termodinamiğin alanına girmektedir.
İstatistiksel Termodinamik, mikroskobik mertebedeki atomik parçacık etkileşimleri ile ilgilenirken; makroskopik mertebede incelemeler ise moleküllerin ortalama toplam tesirlerini dikkate alarak yapılan analizler Klasik Termodinamik kapsamına girer.
Termodinamik Sistemler
Termodinamik analiz , üzerinde çalışılacak olan kütlenin ya da hacmin seçilmesiyle yani sistem seçimi ile başlar.
Sistem : Termodinamik açıdan incelenmek üzere seçilen kütle ya da hacimdir.
Çevre : Sistemin dışında bulunan her şey çevre olarak adlandırılır.
Sistem sınırı : Sistemi çevresinden ayıran yüzeye sınır denir. Sistem sınırı gerçek veya hayali bir yüzeydir. Sistem sınırı sabit ya da hareketli olabilir.
Kapalı ve Açık Sistemler
Kapalı sistem veya diğer adıyla kontrol kütlesi , sınırlarından kütle geçişi olmayan sistemdir. Kapalı sisteme kütle girişi veya çıkışı olamaz. Kapalı sistemlerin özel bir tipi olan izole sistemlerde hem enerji hem de kütle geçişi gerçekleşmez.
Açık sistem veya diğer adıyla kontrol hacmi , uzayda belirlenen problemin çözümüne uygun bir şekilde seçilmiş bir hacmi temsil etmektedir. Kontrol hacmi genellikle kompresör, türbin, lüle gibi içinden akışkan akışı olan ekipmanların analizlerinde gereklidir. Bu ekipmanların içindeki akışların termodinamik analizinde, yaygın olarak ekipmanların fiziksel sınırları sistem sınırları olarak ele alınır
Kapalı sistem, sınırlarından yalnızca kütle geçişi olmayan sistemlerken; açık sistem, sınırlarından kütle ve enerji geçişli olan sistemlerdir. Açık ve kapalı sistemlerde kullanılan matematik ifadeler farklıdır.
Saf Madde
Sistem boyunca maddenin kimyasal bileşimi değişmiyor ve homojen kalıyorsa bu maddeye saf madde denir. Bir saf madde katı, sıvı ve gaz fazlarında bulunabileceği gibi bu fazların karışımı olarak da bulunabilir.
Maddenin faz değişimi sırasında maddenin birçok özel hali ortaya çıkar. Örneğin, saf bir sıvı madde sabit basınç altında ısıtıldığında buharlaşır yani sıvı fazdan gaz fazına geçer. Buharlaşmanın başladığı sıcaklık doyma sıcaklığı olarak adlandırılır. Doyma sıcaklığına karşı gelen basınç ise doyma basıncı olarak adlandırılır. Doyma basınç ve sıcaklığındaki sıvı doymuş sıvı , buhar doymuş buhar olarak adlandırılır.
Doyma basınç ve sıcaklığında bulunan kısmen sıvı ve kısmen buhar fazındaki saf madde ise doymuş ıslak buhar denir
Doymuş ıslak buhar içindeki buhar miktarını buhar kalitesi ya da kuruluk derecesi olarak tanımlar ve x ile gösteririz. Kuruluk derecesi, aşağıdaki ifade ile verilir.
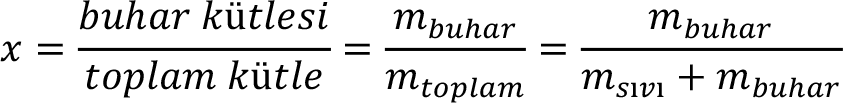
Sistemin Hal ve Özelliği
Bir sistemin tanımlanabilmesi için hem ölçülebilen hem de hesaplanabilen karakteristiklerinin yani özeliklerinin bilinmesi gerekir. Termodinamikte Basınç (P), hacim (V), sıcaklık (T) ve kütle (m) ölçülebilen büyüklüklerdendir. Basit sıkıştırılabilir bir saf maddenin hali yalnızca iki özelliğin bilinmesiyle tespit edilebilir. P, V, T ve m in bilinmesi maddenin termodinamik davranışında büyük önem taşır.
Termodinamikte özelikler iki ana grupta sınıflandırılabilir:
- Bağımlı (yaygın, ekstensif) özelikler,
- Bağımsız (yoğun, intensif) özelikler.
Eğer bir özelik, sistemi oluşturan bütün parçaların değerlerinin toplamı sonucunda elde ediliyorsa bu bağımlı bir özeliktir .
Eğer özelik madde miktarına bağlı değil ise bağımsız özelik olarak adlandırılmaktadır.
Bağımlı bir özelik kütleye bölünerek bağımsız özelik olabilir.
Hal Değişimi ve Denge
Denge, statikte karşıt kuvvetlerin eşit olmasını ifade ederken, termodinamikte denge verilen bir zamanda sistemin her noktasındaki özeliklerin aynı olduğunu göstermektedir. Sistemin denge halleri şöyle sıralanabilir:
Isıl denge ; sistemin her noktasında sıcaklığın aynı olması durumudur
Mekanik denge ; sistemin her noktasında basıncın aynı kalması durumudur.
Kimyasal denge ; sistemin kimyasal bileşiminde bir değişiklik olmadığı durumdur.
Termodinamik denge ; sistemin tüm denge hallerine sahip olduğu durumdur
Sistemin özeliklerinden birisinin değişmesi durumunda sistem hal değiştirir. Sistemin hal değişimi esnasında denge halinden uzaklaşmasının sonsuz küçüklükte gerçekleşmesine Sanki Dengeli Hal Değişimi denir. Bu durumda bütün sistemin denge şartlarını koruduğu varsayılır.
Bazı hal değişimlerinde, değişim boyunca sistem özeliklerinden biri sabit kalır. İzotermal işlemler sabit sıcaklıkta, izobarik işlemler sabit basınçta ve izokorik işlemler ise sabit hacimde gerçekleşen işlemlerdir.
Özgül Hacim
Bir maddenin özgül hacmi birim kütlesinin hacmi olarak tanımlanır, birimi m 3 /kg dır. Özgül hacmin biriminden de anlaşılacağı gibi yoğunluğun (d) (kg/ m 3 ) tersidir.
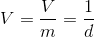
Verilen bir x kalitesindeki buharın özgül hacmi (m 3 /kg) aşağıdaki gibi hesaplanarak bulunur:
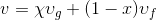
Burada;
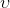 doymuş ıslak buharın özgül hacmi,
doymuş ıslak buharın özgül hacmi,
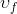 doymuş sıvının özgül hacmi ve
doymuş sıvının özgül hacmi ve
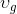 doymuş buharın özgül hacmidir.
doymuş buharın özgül hacmidir.
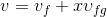
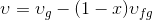
kullanılarak hesaplanabilir.
Basınç
Termodinamik analizlerde daha çok basıncın mutlak değeriyle ilgilenilir. Ancak basınç ölçen cihazlar daha çok atmosfer basıncından itibaren ölçüm yaptıkların için gösterdikleri değerler mutlak basınçla atmosfer basıncı arasındaki farktır. Bu fark efektif basınç olarak adlandırılır. Atmosfer basıncı altındaki basınçlar vakum olarak adlandırılır ve burada okunan efektif basınç negatif değer alır (S:57, Şekil 3.7).
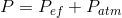 dir
dir
Enerji ve Entalpi
Enerji doğada mekanik, elektrik, kimyasal, nükleer gibi değişik biçimlerde bulunur. Sistemlerin sahip oldukları toplam enerji, bu enerjilerin tümünü kapsar ve E ile gösterilir. Termodinamik analizlerde toplam enerji sırasıyla U iç enerji, KE kinetik enerji ve PE potansiyel enerji toplamıdır. Yani,
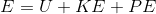 dir.
dir.
İç Enerji
İç enerji
kütleye bağlı, maddenin içyapısıyla ilgili bir bağımlı özeliktir, U ile gösterilir. Özgül iç enerji
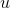 ise aşağıdaki şekilde tanımlanır:
ise aşağıdaki şekilde tanımlanır:
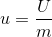
Yani birim kütle başına iç enerjidir. Birimi kJ/kg’dir.
Bir saf maddenin iç enerjisi termodinamik tablolardan yararlanılarak bulunur. Verilen bir x kalitesindeki buharın özgül iç enerjisi
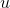 , aşağıdaki gibi hesaplanarak bulunur:
, aşağıdaki gibi hesaplanarak bulunur:
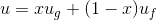
Burada;
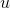 doymuş ıslak buharın özgül iç enerjisi,
doymuş ıslak buharın özgül iç enerjisi,
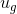 doymuş sıvının özgül iç enerjisi ve
doymuş sıvının özgül iç enerjisi ve
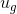 doymuş buharın özgül iç enerjisidir.
doymuş buharın özgül iç enerjisidir.
Entalpi
Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. Termodinamikte belli şartlarda bazı termodinamik özellikler grup halindedir. İç enerji (U) ile basınç (P) ve hacim (V) çarpımı olan PV, sık sık U+PV şeklinde bir araya gelir. Termodinamikte bu grup, entalpi olarak adlandırılır ve H ile gösterilir. Birimi kJ’dur ve aşağıdaki denklem ile verilir:
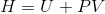
Bir saf maddenin entalpisi, iç enerjiye benzer şekilde tablolar aracılığıyla bulunabilir. Doymuş ıslak buharın entalpisi ise aşağıdaki şekilde verilir:
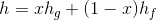
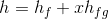
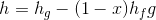
Burada; h doymuş ıslak buharın özgül entalpisi, h f doymuş sıvının özgül entalpisi ve h g ise doymuş buharın özgül entalpisidir.
Sıcaklık
Günlük hayatımızda sıkça kullandığımız bir fiziksel özellik olmasına rağmen sıcaklığı tam olarak tanımlayabilmek oldukça zordur. Bir nesneye dokunduğumuzda sıcaklığı;
- Sıcak ,
- Soğuk ve
- Ilık gibi göreceli olarak tarif edebiliriz. Sıcaklık ölçeği termodinamiğin sıfırıncı yasasına dayanarak tanımlanmıştır.
Sıfırıncı Yasa
Termodinamiğin sıfırıncı yasası ısıl denge kavramından yararlanır. Yasaya göre iki ayrı cisim bir üçüncü cisim ile ısıl dengede ise cisimlerin de kendi aralarında ısıl dengede olacaklarını belirtmektedir. Bu yasa sıcaklık ölçümlerinin geçerliliği açısından gerekli bir yasadır.
Günümüzde farklı sıcaklık ölçekleri ya da skalaları kullanılmakla beraber tümü bir maddenin kaynama ve donma noktaları gibi sıcaklık değerlerine dayanmaktadır. Bu sıcaklıklar buz noktası ( 1 atm basınçta su ve buz karışımının dengede olduğu sıcaklık ) veya buhar noktası (1 atm basınç altında su ve buhar karışımının dengede olduğu sıcaklık ) isimleriyle anılmaktadırlar.
Sıcaklık ölçeklerinin yanında termodinamikte maddelerin özeliklerinden bağımsız bir sıcaklık ölçeği kullanılmak istenmiş ve termodinamiğin ikinci yasasıyla ilişkili olarak termodinamik sıcaklık ölçeği ortaya konmuştur. SI birim sisteminde bu ölçek Kelvin (K) mutlak sıcaklık ölçeğidir.
Isı
Yüksek sıcaklıktaki bir cisim düşük sıcaklıktaki bir ortama bırakıldığında veya düşük sıcaklıktaki cisimle temas ettirildiğinde, bırakıldığı çevre ya da temas ettirildiği ortamla aynı sıcaklığa ulaşıncaya kadar bir enerji geçişi olmaktadır. Bu enerji ısı olarak adlandırılır.
Isı ile ilgili olarak kısaca şunlar söylenebilir:
- İki sistem arasında sıcaklık farkından dolayı geçen enerji ısıdır.
- Isı geçişi her zaman yüksek sıcaklıktan düşük sıcaklığa doğru kendiliğinden olur.
- Isı geçişinin gerçekleşebilmesi için mutlaka sıcaklık farkının olması gerekir.
- Aynı sıcaklıktaki sistemler arasında ısı geçişi gerçekleşmez.
- Isı Q ile gösterilir ve SI birim sisteminde birimi J’dür.
-
Isı, hal değişimine yani yola bağlı bir büyüklüktür. Isı için 1 ve 2 gibi iki hal arasında geçen ısı
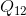 şeklinde gösterilir.
şeklinde gösterilir.
İş
İş fizikten bildiğimiz gibi W ile gösterilir ve F kuvveti ile yol ‘un (L) çarpımıdır. Yani iş W=FL ile hesaplanabilir. İş in SI birim sisteminde birimi J’dür.
Termodinamik Yasaları
Birinci Yasa
Termodinamiğin birinci yasası , enerjinin niceliği ile ilgilidir. Birinci yasa, enerji miktarının korunduğunu, enerjinin yoktan var olmadığını ve vardan yok olamayacağını ifade eden bir korunum yasasıdır.
Termodinamik denklemlerde daima sisteme ısı girişi +Q; ve eğer sistem iş yapıyor ise +W olarak yazılmalıdır. Aksi durumlarda yalnızca terimlerin işareti değişecektir. Birim zamanda gerçekleşen ısı (Q) ve iş (W) geçişlerini göstermek amacıyla, Q ve W üzerine (.) işareti konur.
An denklemi, aşağıdaki ifade ile verilir:
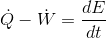
Burada;
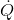 birim zamanda sistem sınırlarından geçen net ısı,
birim zamanda sistem sınırlarından geçen net ısı,
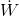 birim zamanda sistem sınırlarından geçen net iş ve dE/dt birim zamanda sistemin enerjisindeki değişimdir.
birim zamanda sistem sınırlarından geçen net iş ve dE/dt birim zamanda sistemin enerjisindeki değişimdir.
Sisteme giren tüm enerjileri pozitif, tüm çıkan enerjileri de negatif işaretli olarak ele alınıp, sistemin hal değişimi için birinci yasa ifadesini bir denklik şeklinde de yazılabilir. Yani;
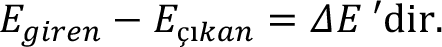
Burada
E
giren
sisteme giren tüm enerjiler,
E
çıkan
sistemden çıkan tüm enerjiler ve
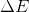 sistemin enerjisindeki (U, KE, PE vb.) değişimi temsil eder.
sistemin enerjisindeki (U, KE, PE vb.) değişimi temsil eder.
İkinci Yasa
Termodinamiğin ikinci yasası ; enerji geçişlerinin ancak belli bir yönde gerçekleşebileceğini, gerçek olayların olduğu gibi geriye dönülemeyecek şekilde meydana geldiğini bu nedenle de her geçişte enerjinin kullanılabilir iş kapasitesinin neden azaldığını açıklayan, enerjinin niteliği ile ilgili bilgiler sağlayan yasadır. En önemlisi, enerji korunumu hesabına göre uygun olduğu halde işlemlerin gerçekleşip gerçekleşemeyeceğini bir hesapla ortaya koyabilmemizi sağlayacak büyüklükleri ortaya koyar.
İkinci Yasanın İfadeleri
İkinci yasa Kelvin-Planck ve Clausius ifadeleri ile anlatılır. Bu ifadelerde yer alan terimler aşağıda kısaca açıklanmıştır.
Isı kaynağı : Isı çekildiğinde ya da ısı atıldığında sıcaklığı değişmeyen sonsuz kapasiteli kabul edilebilecek ısıl enerji deposudur. Sıcaklığı yüksek olan ısı kaynaklarına yüksek sıcaklıklı sıcak ısı kaynağı ya da kısaca ısı kaynağı denir. Düşük sıcaklıktaki ve ısıl enerjinin atıldığı kaynak ise soğuk ısı kaynağı ya da ısıl enerji kuyusu denir.
Termodinamik çevrim : Hal değişimlerinin peş peşe meydana gelerek yeniden başlangıç haline ulaşılmasıyla ortaya çıkan dönel hal değişimidir.
Çalışan akışkan : Çevrim boyunca ısı geçişi olan ve hal değiştiren akışkana iş yapan akışkan ya da çalışan akışkan denir.
Isı makinesi : İş üreten makinedir. Şimdi adı geçen ifadeleri tanımlayalım.
Kelvin-Planck İfadesi : Isı makinelerinin dayandığı esası açıklayan ikinci yasa ifadesidir. Bir ısı makinesinde hedef iş üretmektir. Bunun için bir ısı kaynağından ısı çekilmesi ve çekilen ısının bir kısmının atılması gerektiğine göre, Kelvin-Planck ifadesi aslında, ısı makinelerinin veriminin hiçbir zaman % 100 olamayacağını söylemektedir. Bir ısı makinesinin verimi aşağıdaki gibi tanımlanır:
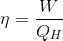
Burada , ? verim ve Q H ısı kaynağından çekilen ısıdır.
Clausius İfadesi : “ Isıyı bir düşük sıcaklık kaynağından yüksek sıcaklık kaynağına kendiliğinden aktaracak bir makine yapmak olanaksızdır .” Bu ifadede yer alan en önemli terim “ kendiliğinden ” kelimesidir. Burada kastedilen “ çevrede hiçbir tesir bırakmayarak ” işlemin meydana gelebilmesidir. Eğer ısı aktarımını dışarıdan iş vererek sağlayacak olursak çevrede değişiklik yapılmış olur.
Bu çevrimlerde kullanılan akışkana soğutucu akışkan ya da soğutkan denir. Soğutma tesiri için kullanılacak makineler soğutma makineleri ısıtma tesiri yaratmak için kullanılacak makineler ise ısı pompası olarak adlandırılır.
Genelde ısı pompası ve soğutma makinesinin verimi yerine performansından bahsedilir. Performans katsayıları (Coefficient of performance – COP) aşağıdaki gibi tanımlanır: