GENEL KİMYA II - Ünite 4: Kimyasal Kinetik Özeti :
PAYLAŞ:Ünite 4: Kimyasal Kinetik
Giriş
Kimyasal kinetik : Bir tepkimede tepkenlerin ürünlere dönüşümü sırasında ne olduğu ve ne kadar hızlı olduğunu inceleyen kimyanın bir dalıdır. Bir tepkimenin hızını belirlemenin yanı sıra tepkime mekanizmasının aydınlatılması konusuyla da ilgilidir.
Kimyasal kinetik tepkime hızları ve mekanizmaları ile ilgilenir.
Tepkime Hızı
Bir süreçteki birim zamandaki değişim hız olarak ifade edilmektedir. Kimyasal tepkimede birim zamandaki değişim olarak tepken ve ürünlerin derişimlerindeki değişimden söz edilmektedir.
A › B şeklinde yürüyen bir tepkimede;
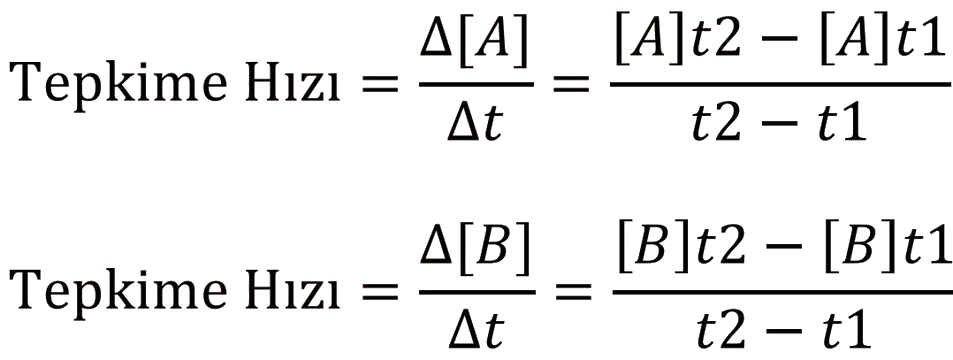
şeklinde formülle gösterilir. Burada sözü edilen tepkime hızı belli bir zaman aralığındaki tepkime hızı olduğundan ortalama tepkime hızı dır.
Kimyasal kinetikte tepkimenin belli bir anındaki hıza karşılık gelen kavram ise anlık hızdır. Anlık hız , herhangi bir t anındaki hızdır.
Tepkimenin başladığı andaki (t=0) anlık tepkime hızına tepkime başlangıç hızı adı verilmektedir.
Ortalama tepkime hızı bir zaman aralığındaki hız anlık tepkime hızı belli bir t anındaki hızdır. Ortalama hızda zaman aralığı sıfıra yaklaştığım zaman ortalama hız anlık hıza yaklaşır.
Derişimin Tepkime Hızına Etkisi: Hız İfadesi ve Tepkime Derecesi
Bir tepkime için zamana bağlı tepkime bileşenlerinin derişimleri deneysel ve olarak belirlendikten sonra tepkime kinetiği çalışmaları bir veya daha fazla tepkenin derişimi ile tepkime hızı arasındaki matematiksel ilişkiyi veren hız ifadesi önem kazanmaktadır.
Hız ifadesi ; hız ve derişimler arasındaki ilişkiyi ifade eder ve daima tepken derişimleri ile bir veya daha fazla sabitin bir fonksiyonudur
Genel tepkime denklemi: aA + bB › cC + dD
Tepkime Hızı=k[A] m [B] n şeklinde gösterilmektedir.
k sabiti, hız sabitidir ve sıcaklığın sabit kalması koşulu ile tepken veya ürün derişimlerinde meydana gelen değişimlerden etkilenmemektedir. Tepkime hızı zamana bağlı olarak değişebilmekte iken k ’nın değeri tepkime süresince sabit kalmaktadır.
Tepkime hızı yüksek olan reaksiyonlarda k sabitinin değeri büyük iken, yavaş hızlı tepkimelerde k sabitinin değeri küçük olmaktadır. k sabitinin sayısal değeri tepkime hızı ile ilgili önemli bilgiler verebilmektedir.
m ve n ifadeleri tepkime hızının A ve B tepkenlerinin derişimlerine ne oranda bağlı olduğun açıklayabilmektedir. Ayrıca tepkenlere göre tepkime derecelerini de ifade etmektedir. A tepkenine göre tepkime derecesi m iken B tepkenine göre ise n. derecedendir. Bu üslerin toplamı tepkimenin tepkime toplam derecesini vermektedir. Yani tepkime derecesi hız ifadesinde yer alan derişim terimlerinin toplamıdır.
Hız İfadesinin Deneysel Olarak Belirlenmesi: Başlangıç Hızları Yöntemi
Bir tepkimenin hız ifadesini türetebilmek için tepken başlangıç derişimlerinin bir fonksiyonu olarak tepkimenin başlangıç hızlarının ölçüldüğü bir seri deney yürütmek gerekir. Bu şekilde belirlenecek olan hız ifadesindeki üslerin sayısal değerleri yani tepkime hızının her bir tepken derişimine göre derecesi belirlenir. Eğer bir tepkime bir tepkene göre sıfırıncı dereceden ise onun tepkimede derişiminin değişmesi tepkime hızını etkilemez. Eğer bir tepkime bir tepkene göre birinci dereceden ise o tepkenin derişimdeki değişme tepkime hızının aynı oranda değişmesine sebep olur. Bu durumda tepken derişimi iki katına çıkınca tepkime hızı da iki katına çıkar. Tepkime bir tepkene göre ikinci dereceden olduğu zaman tepken derişimi örneğin iki katına çıkarsa tepkimenin hızı da dört katına çıkar. Tepkime bir tepkene göre üçüncü dereceden ise tepkenin derişiminin iki kat artırılması durumunda tepkimenin hızı sekiz kat artar. Hız denklemleri ile ilgili çalışmalarda tepkime hızının derişime bağlı olduğunu ancak hız sabitinin bağlı olmadığını hatırlamak gerekir.
Derişimin Zamana Göre Değişimi
Birinci Dereceden Tepkimeler
Birinci dereceden bir tepkimenin hızı, tek bir tepkenin derişiminin birinci kuvvetine bağlıdır.
Yarılanma ömrü ; bir maddenin (tepkenin) derişiminin kütlesinin veya basıncının yarıya düşmesi için geçmesi gereken zamandır.
İkinci Dereceden Tepkimeler
İkinci dereceden bir tepkimenin hızı, iki farklı tepkenin her birine birinci dereceden bağlı olan veya bir tepkenin derişimine ikinci dereceden bağlı olan tepkimelerdir.
Sıfırıncı Dereceden Tepkimeler
Sıfırıncı dereceden bir tepkimenin hızı, derişim terimlerindeki üslerin toplamı sıfırdır. Tepkime hızı tepken derişimden bağımsızdır. Tepkime hızı hız sabitine eşittir.
Etkinleşme Enerjisi
Arhenius moleküllerin tepkimeye girmek için belirli bir değerde kinetik enerjiye sahip olmaları gerektiğini ifade etmiştir. Eğer iki molekül toplamda bu enerjiden daha az enerjiye sahipken çarpışırlarsa çarpışmanın ardından birbirlerinden ayrılarak farklı yönlere giderler. Tepkime gerçekleşmez.
Çarpışan moleküllerin sahip olması gereken minimum enerjiye tepkimenin etkinleşme enerjisi denir. Sayısal değeri her bir tepkime için farklıdır ve bu değer deneysel olarak b ulunur.
Potansiyel enerji diyagramı yardımıyla tepkenlerin etkileşmesi ile çarpışmasıyla birlikte sistemin enerjisi artmakta ve bir maksimuma ulaşmaktadır. Bu maksimum noktadaki sistemin haline geçiş hali denir. v Geçiş halinde tepken moleküllerindeki bağların kırılmakta olduğu ve ürün moleküllerindeki bağların oluşmakta olduğu bir yapı oluşur. bu yapıya etkinleşmiş aktifleşmiş kompleks denir.
Etkinleşmiş kompleks yeniden tepkenlere dönüşebilirken yeni bağ düzenine sahip maddelere (ürünlere de) dönüşebilir. Tepkimelerin büyük bir çoğunluğunda tepkenlerin ürünlere dönüşmeden önce bu yüksek enerjili halden geçmeleri gerekir. Dolayısıyla tepkime sırasında bu enerji engelinin aşılması gerekmektedir. Tepkime gerçekleşirken oluşan bu yüksek enerjili halin enerjisi ile moleküllerinin tepkimenin başlangıcındaki toplam enerjisi arasındaki fark tepkimenin etkinleşme enerjisidir.
Sıcaklık ve Tepkime Hızı: Arhenius Eşitliği
Kimyasal tepkimelerin hızı sıcaklık artışı ile artar. Daha yüksek sıcaklıkta daha yüksek hız elde edilmesi sıcaklık artışıyla tepkime hız sabitinin artmasından kaynaklanmaktadır.
Tepkime Mekanizması
Bazı kimyasal tepkimelerde tek basamakta basit tepkimede ürünler oluşurken çoğu tepkime için ürünler birkaç basamak sonunda oluşur. Dolayısıyla bir kimyasal tepkimeye ait denkleştirilmiş tepkime denklemi çoğunlukla birkaç basit tepkime basamağının toplamıdır ve bu denklem tepkimenin nasıl oluştuğu hakkında herhangi bir bilgi vermez. Bu noktada tepkimenin nasıl oluştuğunu ve hangi basamaklardan geçtiğini anlamak için uygun bir tepkime mekanizmasının önerilmesi önemlidir: Tepkime mekanizması tepkenlerin ürünlere dönüşürken oluştuğu düşünülen atomik değişimleri tanımlayan basit tepkimeler dizisidir.
Önerilen tepkime mekanizmalarında basamaklardan biri daima diğerlerine göre daha yavaş yürür ve bu basamak tüm tepkime için hız belirleyen basamak olarak isimlendirilir. hız belirleyen basamak tüm tepkime hızını sınırlar.
Basit Tepkimeler
Basit tepkime, tek bir adımda basamakta oluşan tepkimedir. Basit tepkimeye tepken olarak katılan moleküllerin sayısına tepkimenin molekülaritesi denir. Eğer tepkime Eğer tepkime tepken olarak tek bir molekül içeriyorsa tepkimeye unimoleküler tepkime, iki molekül içeriyorsa bimoleküler tepkime, üç molekül içeriyorsa termoleküler tepkime denir. Termoleküler tepkimelerin gerçekleşme olasılığı unimoleküler ve bimoleküler tepkimelere göre oldukça azdır.
Çok Basamaklı Tepkimelerin Mekanizmaları ve Hız İfadeleri
Bir kimyasal tepkimede denkleştirilmiş tepkime denklemi ile gösterilen net değişim basit tepkimeler dizisinden oluşan çok basamaklı bir mekanizma ile oluşabilir.
Basit tepkimede oluşan ve ardından gelen tepkimede tüketilen moleküllere atomlara ara ürün denir.
Kataliz
Bir kimyasal tepkimenin hızı tepken derişimi veya sıcaklık artırılarak arttırılabileceği gibi tepkime ortamına katalizör ilavesi de arttırılabilir. Katalizörler tepkimenin daha düşük etkinleşme enerjisini sahip farklı bir mekanizma üzerinden yürümesini sağlayarak tepkime hızını artıran maddelerdir. Katalizörler denkleştirilmiş tepkime denkleminde yer almazlar. Tepkime sonunda değişime uğramazlar.
Kataliz bir kimyasal tepkimenin hızının katalizör varlığında arttırılması sürecidir ve homojen ve heterojen kataliz olarak sınıflandırılır. Homojen katalizde katalizör tepkenler ve ürünler ile aynı fazdadır. Diğer yandan heterojen katalizör katalizör tepken ve ürün moleküllerinden farklı fazda olur. Heterojen katalizde tepkenler genellikle gaz ya da çözeltidedir. Katalizörler ise tepkenler ile temasta olan genellikle bir katıdır. Endüstriyel açıdan önemli olan birçok reaksiyon katı haldeki katalizör yüzeyinde gerçekleştirilir.
Hız ifadesi bazı kaynaklarda hız yasası veya hız eşitliği olarak da ifade edilmektedir. Tepkime derecesi hız ifadesindeki derişim terimlerinin üslerinin toplamıdır.
Başlangıç hızları yöntemi ile bir tepkimeye ilişkin hız ifadesi belirlenirken genellikle tepkenlerden birinin derişimi basit katlarda artırılırken diğerlerinin derişimleri sabit tutulur ve bu şekilde başlangıç hızlarının ölçüldüğü bir seri deney yürütülür.


