GENEL KİMYA II - Ünite 6: Yükseltgenme-İndirgenme ve Elektrokimya Özeti :
PAYLAŞ:Ünite 6: Yükseltgenme-İndirgenme ve Elektrokimya
Yükseltgenme-İndirgenme Tepkimeleri
Yükseltgenme-indirgenme (redoks) tepkimeleri; kısmen veya tamamen elektron aktarımı içeren tepkimeler olarak adlandırılır.
Yükseltgenme : bir redoks tepkimesinde elektron veren madde yükseltgenmiş olur. Aynı zamanda karşısındaki maddeyi indirgemiş olduğu için indirgen madde olarak adlandırılır.
İndirgenme : bir redoks tepkimesinde elektron alan madde indirgenmiş olur. Aynı zamanda karşısındaki maddeyi yükseltgemiş olduğu için yükseltgen madde olarak adlandırılır.
Yükseltgenme sayısı (yükseltgenme basamağı) ; atomdaki negatif ve pozitif yüklerin toplamı olarak tanımlanabilir.
Yükseltgenme Sayılarının Belirlenmesi
- Bir elementin atomunun yükseltgenme sayısı sıfırdır.
- Tek atomlu iyonlarda yükseltgenme sayısı iyonun yüküne eşittir.
- Çok atomlu iyonlarda iyonun yükseltgenme sayısı formüldeki her bir atomun yükseltgenme sayılarının toplamı olarak iyonun yüküne eşittir.
- Bir bileşikteki atomların yükseltgenme sayılarının toplamı sıfırdır.
- Hidrojenin yükseltgenme sayısı metal hidrürlerinde -1 ve diğer bütün bileşiklerinde +1’dir.
- Oksijenin yükseltgenme sayısı peroksit bileşiklerinde (O 2 2- ) -1, süper oksit bileşiklerinde (O 2 - ) -1/2, OF 2 ’de +2, diğer bütün bileşiklerinde ise -2’dir.
- Alkali metallerin (Li, Na, K, Rb, Cs ve K) yükseltgenme sayıları +1 ve toprakalkali metallerin (Be, Mg, Ca, Sr, Ba ve Ra) yükseltgenme sayıları +2’dir
Yükseltgenme-İndirgenme Tepkimelerinin Denkleştirilmesi
Yükseltgenme-indirgenme tepkime denkleminin denkleştirilmesinde sırasıyla aşağıdaki basamaklar uygulanır:
- Tepkime denkleminden indirgenme ve yükseltgenme yarı tepkimeleri belirlenerek yazılır.
- Bu yarı tepkimeler ayrı ayrı denkleştirilir.
- Denkleştirilmiş her iki yarı tepkime elektron sayıları aynı olacak şekle getirilerek tekrar yazılır.
- Her iki yarı tepkime toplanarak toplam tepkime denklemi elde edilir.
- Toplam denklemin denk olup olmadığı kontrol edilir.
Elektrokimyasal Hücreler
Elektrokimyasal hücre : Yükselgenme-indirgenme tepkimelerinin gerçekleştirildiği düzeneklere verilen addır. Piller, akümülatörler vb. bu düzeneklere örnek olarak verilebilir.
Hücre içinde kendiliğinden yürüyen tepkimeyle kimyasal enerjiyi elektrik enerjisine çeviren elektrokimyasal hücre galvanik hücre , voltaik hücre veya pil olarak adlandırılır.
Hücreden elektrik akımı geçirilerek kendiliğinden gerçekleşmeyen bir kimyasal tepkimenin gerçekleştirildiği elektrokimyasal hücre ise elektrolitik hücre olarak adlandırılır.
Elektrolit çözelti , yüklü iyonların hareketiyle elektrik akımını ileten çözeltidir.
Hücrede yükseltgenmenin meydana geldiği elektroda anot , indirgenmenin meydana geldiği elektroda katot denir.
İki farklı çözelti arasındaki difüzyon potansiyelini düşürmek için kullanılan, iki çözelti arasındaki elektrik akımının geçişini sağlayan ve içinde elektrolit bulunduran köprü şeklinde cam boruya tuz köprüsü denir.
Galvanik hücre : Galvanik hücrede oluşan yükseltgenme ve indirgenme yarı tepkimeleri sonucunda hücrenin pozitif ve negatif kutupları arasında potansiyel farkı oluşur. Hücrenin iki ucu arasında bir potansiyel farkı yoksa, pil tükenmiş olur, yani daha fazla akım üretemez.
Hücre potansiyeli : Bir hücreden akım geçmediği durumdaki hücrenin iki ucu arasında ölçülen potansiyel farkına hücre potansiyeli veya elektromotor kuvveti (emk) denir ve E ile gösterilir. Hücrenin 25 °C ve 1 atm basınçta yani standart koşullardaki hücre potansiyeline standart hücre potansiyeli denir ve E° ile gösterilir.
25 °C’de, aktişiği 1 olan H+ iyonları içeren çözeltiye daldırılan platinle kaplanmış platin elektrot üzerine 1 atm basınçta hidrojen gazı gönderilerek hazırlanan elektroda Standart hidrojen elektrodu denir.
Redoks Tepkimelerinin İstemliliği
Bir galvanik hücrede yürüyen redoks tepkimesiyle kimyasal enerji, elektrik enerjisine dönüşür. Standart koşullarda yürüyen hücre tepkimesi için standart serbest enerji değişimi de (?G°) aşağıdaki gibi yazılır.
?G°=-nFE°
Kendiliğinden yürüyen bir tepkime için ?G negatiftir. Bu eşitliğe göre de ?G°’nin negatif olması için E° pozitif olmalıdır.
Nernst Eşitliği
Hücre potansiyelinin derişim ve basınçla değişimine ait formül Nernst Eşitliğini verir.
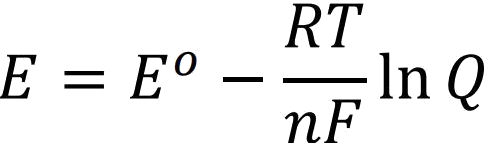
Bu eşitlikte 298 K için RT/F değeri 0,0257 V olduğundan;
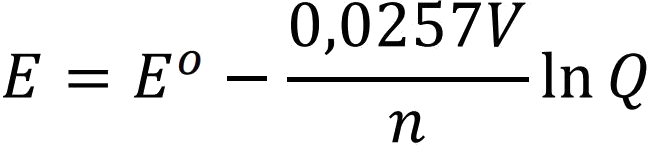
olarak bulunur.
Derişim hücreleri : Farklı derişimlerde çözelti içeren aynı yarı hücrelerin uygun şekilde bağlanmasıyla oluşturulan hücreye verilen addır.
Piller
Elektrik kaynağı olarak kullanılabilen elektrokimyasal hücrelere pil denir. Piller seri bağlanarak daha yüksek potansiyele sahip bir elektrokimyasal hücre elde edilir.
Birincil piller , yaklaşık 1,5 V’luk bir potansiyel sağlarlar
İkincil piller kullanılmadan önce kendiliğinden oluşan tepkimenin yönü dış elektrik kaynağıyla tersine çevrilir ve tepkimeye girenlerin dengede olmayan karışımları oluşturulur.
Yakıt pilleri , hidrojen veya metan gibi yakıtların yanma enerjilerinin elektrik enerjisine dönüştürülmesini sağlayan pillere verilen addır.
Korozyon
Metal veya metal alaşımlarının yükseltgenmesi sonucu aşınması olarak tanımlanan olaya korozyon denir. Demirin paslanması, gümüşün karaması vb. olaylar korozyona örnektir.
Metallerin korozyondan korunması için çeşitli yöntemler bulunmaktadır. Bunlar arasındaki en basit yol, metal yüzeyini bir başka madde ile kaplayarak hava ve su ile temasını engellemektir. Bunun için metal yüzeyi boyanabilir veya bir başka metalle kaplanabilir.
Elektroliz
Elektroliz ; Kendiliğinden yürümeyen bir kimyasal tepkimenin elektrik akımı uygulanarak yürümesinin sağlandığı olaya verilen addır. Elektrolizde kullanılan hücre elektroliz hücresi veya elektrolitik hücre olarak adlandırılır.
Faraday Yasası : Elektrik akımıyla oluşan ürünün mol sayısı stokiyometrik olarak gerekli olan elektronların mol sayısıyla orantılıdır.


