TEMEL VETERİNER BİYOKİMYA - Ünite 1: Biyofiziksel Kimya ve Su Özeti :
PAYLAŞ:Ünite 1: Biyofiziksel Kimya ve Su
Biyofiziksel Kimya ve Organizmanın Temel Maddeleri
Canlı varlıkların yaşamlarını devam ettirebilmeleri için sürekli besin maddesi tüketmeleri ve bunları organizmanın yararlanabileceği şekle dönüştürmeleri gerekir. Sürekli alınan bu besinlerin vücutta oksitlenmesi canlı organizmadaki kimyasal bir olay, yani biyokimyasal bir süreç, bu olay sırasında meydana gelen ısının ölçülmesi fiziksel bir durumdur. Fizik ve canlı kimyası birbiri ile yakından ilgili bilim dallarıdır ve burada olduğu gibi iç içe geçmiş, birbirinden ayrılmaz olayları inceler. Biyofiziksel kimya da canlı organizmadaki fizik ve biyokimyanın birbirine karıştığı böyle olayların kavranmasına yardımcı olur.
Organizmaya dışarıdan alınan maddeler, proteinler (azotlu bileşikler), lipitler, karbonhidratlar, makro ve mikro elementler, su organizmanın temel maddeleridir. Su ortalama olarak %60 oranında bulunan bir maddedir. Bu oranın diğerlerine göre yüksek olmasının sebebi kimyasal reaksiyonların oluşması için sulu ortama ihtiyaç duyulmasıdır. Canlı organizmada bulunan bu temel maddeler birçok doku ve organda birbirine benzer oranlarda bulunsalar da bazıları arasında önemli miktarda farklar vardır. Örneğin, paranşimli dokularda su oranı yüksek, inorganik maddelerin oranı azdır. Paranşimli doku, özel bir zar tarafından etrafı sarılmış ve diğer dokulardan ayrılan böbrek, dalak, karaciğer gibi organlardır. Kemik, diş gibi dokularda ise inorganik maddelerin oranı yüksek buna karşılık su oranı azdır. Su ile inorganik madde arasındaki bu ilişki aynı zamanda su ile lipit miktarı arasında da vardır. Lipitlerin yüksek oranda bulunduğu yağ dokusu gibi yerlerde su oranı azalmaktadır. Yani su ile inorganik madde arasında ve su ile lipit miktarı arasında ters bir orantı vardır. Bir madde artarken diğeri azalmaktadır.
Su ve Metabolizması
Su molekülü, bir atom oksijen ve iki atom hidrojenin kovalent bağ ile birleşmesinden oluşur (Sayfa:4, Şekil 1.1). Şekil olarak V harfine benzetilir. Su molekülü dipol bir yapı oluşturur. Oksijen tarafı negatif (-), hidrojen tarafı pozitif (+) kutupludur. Her su molekülü dört farklı su molekülüyle hidrojen bağı oluşturarak tetrahedral yapı oluşturur (Sayfa:4, Şekil 1.2). Bu yapıda oksijen atomu iki hidrojen atomu, hidrojen atomu da bir oksijen atomu ile bağ yapar. Tetrahedral yapı: Dört su molekülünün birbirine hidrojen bağlarıyla bağlanmasıyla oluşan yapıdır.
Su, hücrede serbest ve bağlı olmak üzere iki şekilde bulunur. Serbest su tüm vücut suyunun %95’ini oluştururken, geriye kalan %5 su ise hidrojen ve buna benzer gevşek bağlarla proteinlere bağlı halde bulunur. Serbest su diğer maddeler için uygun bir çözücü ortam oluşturur. Kan, lenf, beyin omurilik sıvısı gibi çeşitli vücut sıvılarında bulunur. Bağlı su ayrıca kendi içinde iki kısma ayrılır. Bunlar hidrat suyu ve moleküller arası sudur. Hidrat suyu iyonlara, makromoleküllere hidrojen köprüleri ile bağlı olan sudur. Makromolekül, molekül ağırlığı yüz bin ya da milyonlar arasında değişen moleküllerdir. Sodyum, klor, potasyum gibi iyonlar su ile hidrat biçimlerini oluştururlar. Hidratlaşmada (+) yükle yüklü iyonlar dipol karakterli su molekülünün negatif yük merkezine (oksijen), (-) yükle yüklü iyonlar ise pozitif yük merkezine (hidrojen) bağlanırlar. Böylece iyonun merkezde ve su moleküllerinin etrafında yer alması ile hidratlaşma meydana gelir. Sulu çözeltide bütün iyonlar hidratize şekilde bulunur (Sayfa:5, Şekil 1.3). Moleküller arası su, lifler zarlar arasında kalmış, yoğun kıvamlı, akıcılık özelliğini kaybetmiş, hareketsiz haldeki sudur.
Su fonksiyonel açıdan hücre içi sıvısı (intrasellüler sıvı) ve hücre dışı sıvısı (ekstasellüler sıvı) olarak sınıflanır. Hücre dışı sıvısı da kendi arasında hücreler arası sıvı (interstisyel sıvı) ve damar içi sıvı (intravasküler sıvı) olarak bölümlenir. Hücre içi sıvısı organizma suyunun %70’ini, hücreler arası sıvı %20’sini, damar içi sıvı ise %10’unu oluşturur. Ekstrasellüler sıvıda bulunan katyonlar bazik katyonlardır. Bunların %90’ını Na + iyonu oluşturur. Diğerleri başlıca K + , Ca +2 ve Mg +2 iyonlarıdırlar. Ekstrasellüler sıvıda bulunan temel anyonlar ise klorür iyonu, bikarbonattır ve bunların toplamı, temel katyon olan sodyumunkine yakındır. Ekstrasellüler sıvıda daha az miktarda bulunan anyonlar, proteinat, organik asitler, fosfat ve sülfattır. İntrasellüler sıvıda bulunan katyonlar da bazik katyonlardır. Bunların %70’ini K + iyonu oluşturur. Potasyumdan sonra Mg +2 gelir, Na + iyonu intrasellüler sıvıda az bulunur. İntrasellüler sıvıda bulunan temel anyonlar ise fosfat ve proteinattır. Klorür anyonları çok az bulunur. Bu bölümler arasında devamlı su alışverişi vardır.
Suyu geçiren ancak içinde çözünmüş halde bulunan çözünenlere geçirgen olmayan, yani yarı geçirgen bir zar ile birbirinden ayrılmış, aynı kap içerisinde bulunan iki çözelti düşünelim. Bunlar arasında seyreltik çözeltiden derişik çözeltiye doğru her iki taraftaki konsantrasyon farkı eşitleninceye kadar suyun geçmesine izin veren kuvvete ozmotik basınç denir. Canlı organizmanın elde etme kaynağı açısından suyu eksojen su ve endojen su olmak üzere iki gruba ayırmak da mümkündür. Canlı organizmanın dışarıdan aldığı gıdalar ve sıvılarla gelen suya eksojen su, metabolizma olayları sırasında reaksiyonlardan elde edilen suya da endojen su denir.
Suyun organizmadan atılışı iki şekilde olur;
- Akciğerlerden ve deriden buhar halinde
- Dışkı, idrar, ter ile sıvı halinde
Canlılığın sürdürülmesi amacıyla gerekli işlemlerin gerçekleştirilmesi için sıvı bir ortamın varlığı zorunludur. Sıvıların en ideali ise sudur. Canlı vücudunun büyük bir kısmı da sudan oluşmaktadır. Bu su da canlılarda önemli olayların gerçekleşmesinde rol almaktadır.
Büyük moleküllü maddelerin yapısına katılır ve onlara hidrojen köprüleri ile bağlanır. Kasların oluşumunda %7580, kemik dokusunda %25, yağ dokusunda %15-20 ve dişlerin yapısında %5-10 oranında bulunmaktadır.
Su canlı organizmanın ihtiyacı olan, dışarıdan alınan besinlerin sindirim sisteminde meydana gelen olaylar sırasında yumuşatılması, emilmesi ve kan dolaşımı ile gerekli yerlere taşınmasında rol oynar. Ayrıca metabolik olaylar sırasında açığa çıkan artık maddelerin vücuttan uzaklaştırılmasında görev alır.
Suyun vücut ısısının ayarlanmasında önemli görevi vardır. Çünkü yüksek erime noktasına ve buharlaşma ısısına sahiptir. Tüm memeli canlılarda vücut sıcaklığı neredeyse aynı değerlerdedir. İnsanlarda 36-37 C civarındadır ve bu değerlerde tutulması önemlidir.
Hidratize yapılarda yani suda çözünerek ayrışan iyonların su ile etrafının sarılması sonucu oluşan taneciklerdeki hidrojen bağları kovalent bağlara veya kovalent bağlar hidrojen bağlarına değişerek, canlının gereksinim duyduğu şekilde enerjinin düzenli bir şekilde yönetilmesinde etkili olur.
Su özellikle vücudun eklem yerlerinde ve iç organlarda kayganlık sağlayarak, sürtünme ve aşınmadan meydana gelebilecek zararları en aza indirir.
Daha önce açıklandığı gibi canlının kullandığı suyun bir kısmı içilen su ve diğer içeceklerden, bir kısmı gıdaların içinde bulunan sudan, belirli bir miktarı da vücut metabolizması sonucu ortaya çıkan sudan karşılanır. Alınan suyun hemen hepsi idrar, dışkı, ter ve nefes verme yoluyla dışarı atılır. Bu duruma su dengesi adı verilir. Su dengesi canlı vücuduna alınan suyla, vücuttan atılan suyun birbirine eşit olma durumudur. Ortalama yetişkin bir insanda bu denge yaklaşık 2400 ml suyla sağlanır. Bu da günde 8-10 bardak su ve diğer sıvılara eşittir.
Endojen su vücuda alınan organik maddelerdeki hidrojenin oksidasyonundan elde edilir. Alınan gıda maddelerinin özelliği bunlardan elde edilen su miktarını etkiler. Formül yapılarında ne kadar fazla hidrojen varsa, elde edilen su miktarı o kadar fazladır. 100 g proteinin oksidasyonundan yaklaşık 34 g, karbonhidrattan 56 g, yağlardan 109 g endojen su elde edilir. Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
Canlı organizmadaki su dengesinde herhangi bir nedenle farklılık meydana geldiğinde, bu durum kendini bazı bozukluklarla gösterir. Ödem ise vücutta aşırı sıvı birikmesi durumu olarak tanımlanmaktadır. Bu birikim bölgesel veya genel olarak görülebilir.
Çözeltiler ve Özellikleri
Çözelti, bir ya da daha fazla maddenin bir ortamda çözünmesiyle elde edilir. Son zamanlarda çözelti yerine dispers sistem terimi de kullanılmaya başlanmıştır. Bir çözeltinin ya da dispers sistemin iki fazı vardır. Çözünen maddeye iç faz veya dispers faz, çözücüsüne ise dış faz veya dispersiyon ortamı denir. Çözeltideki çözünen maddenin tanecik büyüklüğüne göre üç çeşit çözelti veya dispers sistemden bahsedilir. Hakiki çözelti, kolloidal çözelti ve süspansiyon.
Hakiki çözelti, çözelti içinde çözünen madde taneciklerinin yani iç faz parçacıklarının büyüklüğü 10 nm (nanometre)’den az olan, homojen yapıda, vizkozitesi düşük, ozmotik basıncı yüksek olan çözeltilerdir. Çözünen bu tanecikler filtre kâğıdından süzülerek veya dializ işlemi ile birbirinden ayrılamaz.
Kolloidal çözelti, çözünen tanecik büyüklükleri 10-100 nm arasında olan, heterojen, vizkozitesi yüksek, ozmotik basıncı düşük çözeltilerdir. İçindeki tanecikler dializ işlemi ile ayrılabilir.
Süspansiyon, 100 nm’den daha büyük çözünmüş taneciklere sahip olan, heterojen, vizkozitesi çok yüksek, ozmotik basınç göstermeyen çözeltilerdir.
Yüzde çözelti, 100 ml çözelti içinde, istenilen % kadar gram madde içeren çözeltilere denir.
Sıvı maddelerden % çözelti hazırlamak için yaygın olarak kullanılan bir formül vardır. Bu formül; N 1 xV 1 =N 2 xV 2 ’dir.
N 1 = Elde mevcut olan sıvı maddenin (çözeltinin) %’si
V 1 = Elde mevcut olan sıvı maddenin hacmi
N 2 = Hazırlanması istenilen çözeltinin % ’si
V 2 = Hazırlanması istenilen çözeltinin hacmi
Molar çözelti, litresinde 1 molekül gram veya mol gram madde bulunan çözeltilere molar çözelti denir. Büyük M harfi ile gösterilir. Molar ya da normal çözeltilerin tanımının anlaşılması ve bu çözeltilerin hazırlanmasında maddenin molekül ağırlığının bilinmesi gerekir. Molekül ağırlığı, bir moleküldeki atomların atom kütlelerinin toplamıdır.
Normal Çözelti, bir litresinde 1 ekivalan gram madde bulunan çözeltilere normal çözelti denir. Büyük N harfi ile gösterilir. Ekivalan gram, maddenin molekül ağırlığının tesir değerine (TD) bölünmesi ile elde edilir. Tesir değeri ise asitler, bazlar ve tuzlar için farklılık gösterir. Tesir değeri: Asitlerin ortama verdiği H + iyonu sayısı, bazların ortama verdiği OH – iyonu sayısı, tuzların ortama verdiği veya aldığı elektron sayısına denir. Bazı kimyasal maddelerin tesir değerleri kitabın 11. Sayfasında bulunan Tablo 1.2’de gösterilmiştir.
Normal çözeltilerde de molar çözeltiler gibi sıvı maddelerden normal çözelti hazırlamak istiyorsak, yine bir formülden yararlanarak kolayca hazırlayabiliriz.
Formül;
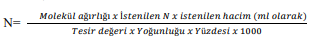
Molar çözeltilerden farklı olarak formülde tesir değeri de yer almaktadır.
Molarite ve normalite arasında N = M x Tesir değeri bağlantısı vardır.
İzotonik Çözelti Canlı organizmanın ozmotik basıncına sahip, nötr çözeltilere izotonik çözeltiler denir. İnsan ve hayvanların hücre içi ve hücre dışı sıvılarının ozmotik basıncı 5,98-7,7 arasındadır. Bu ozmotik basınca sahip çözeltiler arasında 0,16 M sodyum klorür, yine %0,85’lik (binde 85’lik) sodyum klorür, 0,3 M glukoz çözeltisi yer alır.
İnsan veya hayvanlara enjeksiyonla damar içi ilaç verilmesi gerektiği zaman ya da hastalık durumlarında serum takılması gerektiğinde kullanılan sıvıların izotonik çözelti özelliğinde olmasına çok dikkat edilmesi gerekir. Bu duruma dikkat edilmediği zaman hücreler su kaybederek büzüşebilir veya aşırı su alarak sişebilir ve hücrelerin yapısı, bütünlüğü bozularak, hücreyi oluşturan yapılar görev yapamaz hale gelebilirler.
Önemli Bazı Biyofiziksel Olaylar
Diffüzyon, moleküllerin çözeltinin her tarafına kendiliğinden eşit olarak yayılması olayıdır. Yayılma olayı, maddenin yoğunlukça fazla olduğu ortamdan daha az yoğun olduğu ortama doğrudur. Diffüzyon canlı organizmanın madde değişiminde çok önemlidir. Oksijenin havadan kana geçişinde, kandan dokulara taşınmasında aynı şekilde dışarıdan gıdalarla alınan ve en küçük yapı taşlarına kadar parçalandıktan sonra kan yoluyla besin maddelerinin dokulara nakledilmesinde diffüzyon önemli rol oynar. Bu maddelerin taşınmasında yoğunluk farkı gereklidir, yoğunluk farkı ortadan kalkarsa diffüzyon durur. Ancak canlı organizmada alınan bu maddeler hemen kullanılmakta veya kullanılmayacaksa bile daha büyük moleküller şeklinde birbirine bağlanarak depo edilmektedir. Bu nedenle konsantrasyon farkı her zaman mevcuttur.
Dializ, vücutta birikmiş üre gibi zararlı maddelerin ve aşırı suyun yapay böbrek (diyaliz cihazı) ya da karın zarı (periton) gibi yapay ya da doğal bir zar aracılığı ile vücuttan uzaklaştırılması işlemidir. İlerlemiş böbrek yetmezliğinin tedavisinde kullanılır. Küçük ve basit moleküllerin bir zardan geçmesine izin vermek suretiyle onları daha büyük, kompleks moleküllerden ayırma işlemidir. Serum proteinlerinden biri olan ve büyük molekül ağırlığına sahip albümin ile tuz çözeltisi birlikte dializ torbasına koyularak distile su ile dolu bir kabın içine yerleştirilirse, tuz çözeltisi kolaylıkla dializ torbasından dışarı çıkar ancak albümin büyük olduğu için torba içerisinde kalır. Dializ işleminde geçiş çok yoğundan az yoğun ortama doğrudur. Saf su yoğunluk farkı ortadan kalkınca tekrar değiştirilerek, tüm tuz çözeltisinin dışarı çıkması sağlanır. Böylece küçük moleküllü maddelerle büyük moleküllü maddeleri birbirinden ayırmak mümkün olur. Laboratuarlarda difteri ve tetanoz etkenlerine karşı antitoksinler dializ ile saflaştırılır.
Çözünmüş bir madde, içinde çözündüğü çözücünün yüzey gerilimini değiştirir. Sıvı bir maddenin yüzeyi ince ve elastik bir zar ile örtülüymüş gibi görünür. Sıvının yüzey kısmındaki moleküllerin dengelenmemiş molekül içi çekim gücünden ileri gelen bu olaya yüzey gerilimi denir. Sıvı ile dolu bir kap içerisindeki bir moleküle her yönden yani aşağıdan-yukarıdan ve sağdan -soldan eşit bir çekim gücü uygulanır. Bu da sıvı maddenin çekim gücüdür. Yüzeydeki bir molekülü incelersek sağdan ve soldan sıvının çekim gücü tarafından dengelenmiş bir kuvvetle çekildiğini görürüz. Aşağıdan sıvının çekim gücü yukarıdan ise havanın çekim gücü tarafından çekildiği için burada dengelenmemiş bir kuvvet oluşur. Yüzey gerilimi işte bu dengelenmemiş kuvvetten ortaya çıkar (Sayfa:13, Şekil 1.5). Her sıvının yüzey gerilimi farklıdır (Sayfa:13, Tablo 1.3). Suyun yüzey gerilimi, bilinen diğer sıvıların hemen hepsinden daha yüksektir ve bunun çok önemli bazı biyolojik etkileri vardır.


